概要
核磁気共鳴(Nuclear Magnetic Resonance:NMR)法は、分子の化学構造や運動性、相互作用などを調べる手法で、有機化学をはじめとして高分子化学、生物化学、医学等の広い分野で活用されています。
本資料では、溶液NMRによるタンパク質の構造解析における最初のステップである主鎖(アミノ酸連鎖)解析を紹介します。主鎖解析を行うことで、NMRを用いてタンパク質の状態をアミノ酸単位で解析できるようになります(タンパク質–リガンド相互作用(Kd)解析等)。
タンパク質のNMR解析には貴重な安定同位体(13C, 15N)標識試料が必要となりますが、弊社の700MHz NMR装置に備えた1.7mm Cryoプローブを用いることで通常の1/5未満*の試料量(液量40μL)で測定解析が可能です。
*(株)シゲミ製対称形ミクロサンプルチューブ(5mmφ, 液量200~300μL)との比較
分析方法・分析装置
| 分析方法 | 一次元1H、二次元1H-15N HSQC、三次元1H-13C-15N NMR(HNCO, HN(CA)CO) |
| 分析装置 | 700MHz NMR + 1.7 mm Cryoプローブ(1H/13C/15N三重共鳴、インバース型) |
試料
1mM プロテインG B1ドメイン(GB1、13C/15N標識体、6.3kDa) PBS(-)溶液
結果
① タンパク質の1H NMRスペクトル
はじめに試料の1H NMRスペクトルを図1に示します。タンパク質は分子内に多数の水素原子を含むため多数のピークが重複した状態で検出され、詳細な構造解析は多くの場合困難です。したがって、一般的にタンパク質の構造解析には安定同位体(13Cおよび15N)標識を活用した多次元NMR測定が必要です。
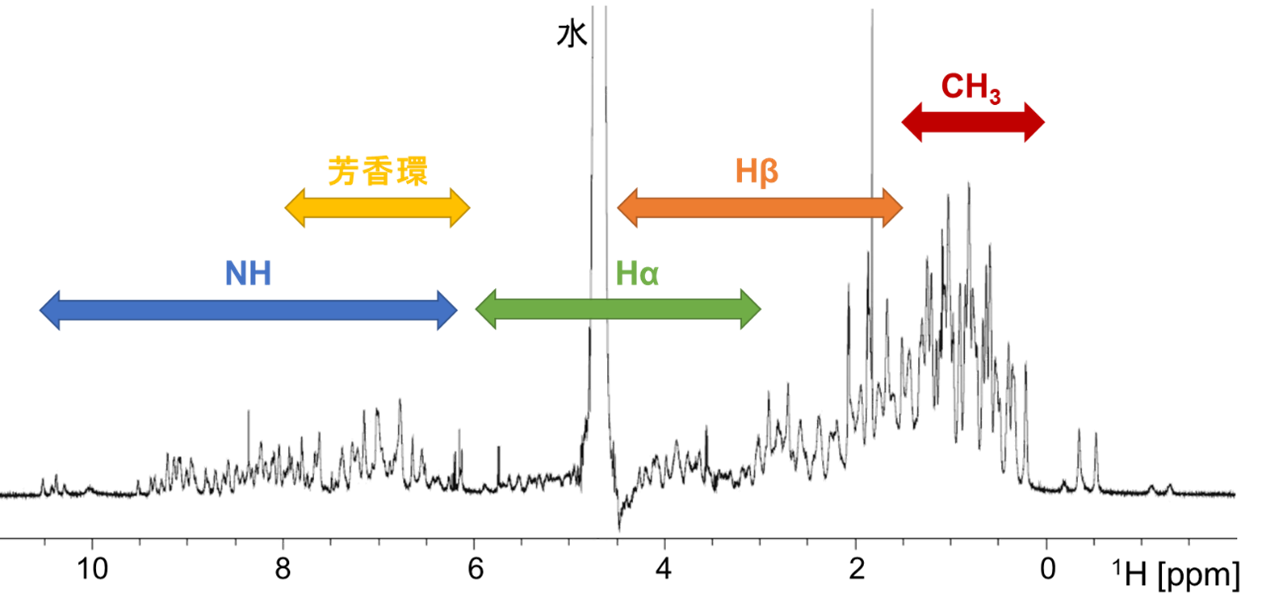
【図1】試料の1H NMRスペクトル(水消しにより水ピークを低減)
② タンパク質の1H-15N HSQCスペクトル
試料の二次元1H-15N HSQCスペクトルを図2に示します。本測定では直接結合した水素と窒素間の相関、すなわちタンパク質では主鎖骨格(-NH-CH(-R)-CO-)中のアミドNHが主にピークとして検出されます。構成アミノ酸一つ一つを個別のピークとして検出できるため、タンパク質解析の基幹となるスペクトルです。
NMRによるタンパク質の主鎖解析の目的は、1H-15N HSQC上のピークを各アミノ酸残基に帰属することです。
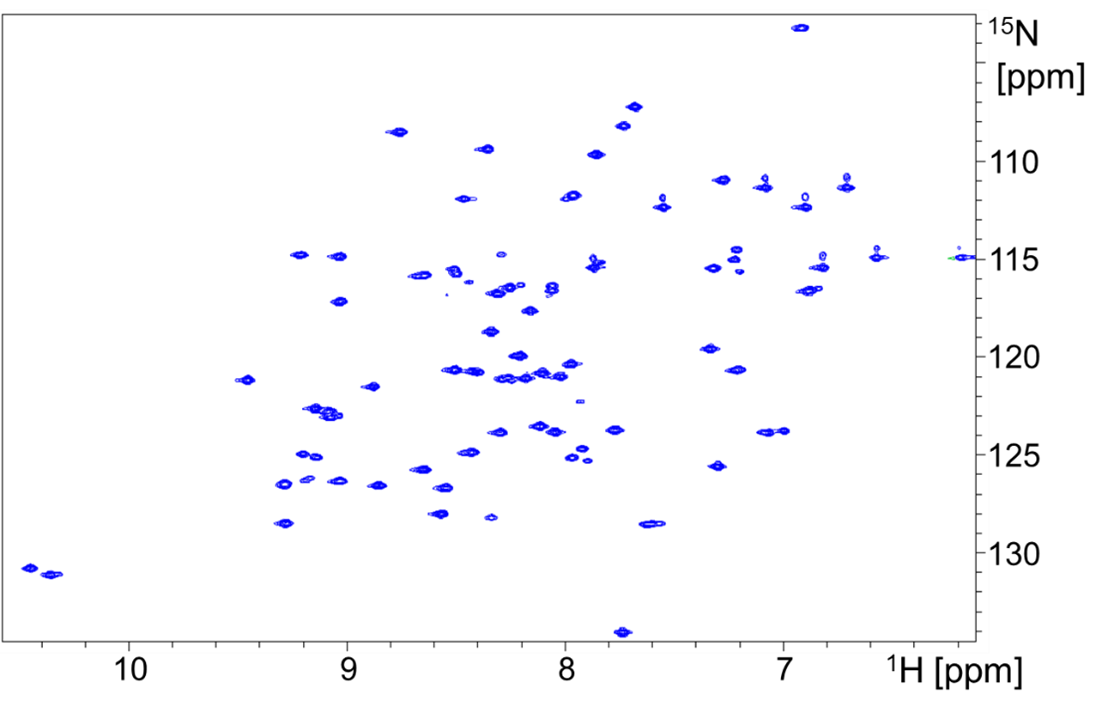
【図2】試料の二次元1H-15N HSQCスペクトル
1H-15N HSQCにおいて、特定の立体構造を形成しているタンパク質であれば図2のようにピークが分散して検出されますが、変性状態のタンパク質はスペクトル中央(1H:8 ppm)付近にピークが集中して検出されます。本スペクトルを取得すると溶液中のタンパク質の状態(フォールディング)を簡易的に判定可能です。
③ 三次元NMR測定を用いたタンパク質主鎖解析の概要
主鎖解析に用いる三次元NMR測定では、任意のアミドNH(図3a青)から周辺炭素(α 位、β 位およびカルボニル(以下Cα, Cβ, COと表記)、図3a赤)のいずれかまで磁化を展開することで、三次元目として13C化学シフト情報を取得します。
三次元NMRスペクトルの解析では、二次元NMRスペクトル(ここでは図2の1H-15N HSQC)上でピークを選び、立方体で示した三次元スペクトルから選択したピークに相当する部分を切り出した短冊(stripと呼ぶ)を取扱います(図3b)。
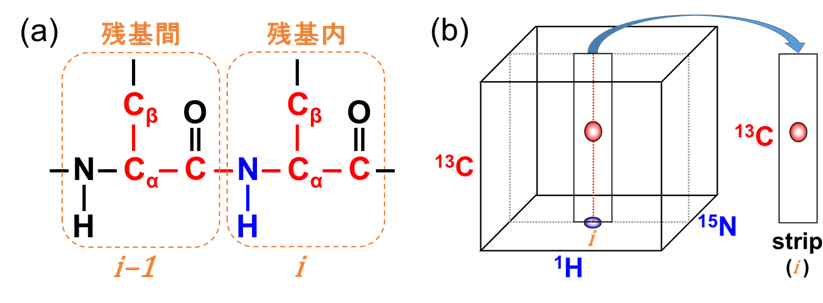
【図3】タンパク質主鎖の模式図(a)と三次元スペクトルのイメージ(b)
COまたはCα を対象とした三次元測定の磁化移動イメージを図4に示します。タンパク質の三次元測定の多くは測定名がそのまま磁化の移動経路を表します(HNCOの場合、H⇔N⇔CO)。主鎖解析ではHNCOとHN(CA)COのように、アミドNH(i番目)から見て残基間(i-1番目)を観測する測定(図4左側)と、残基間(i-1番目)と残基内(i番目)の両方を観測する測定(図4右側)をペアにして解析を行います。
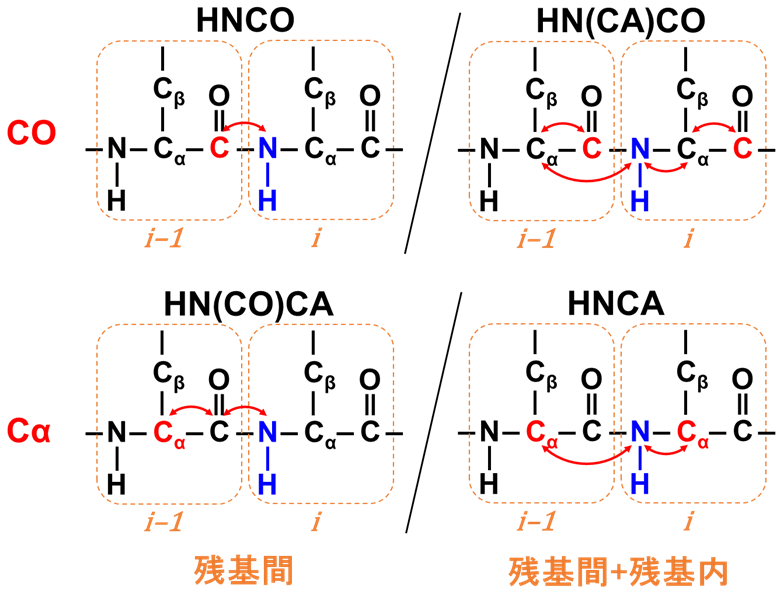
【図4】主鎖解析用三次元測定の磁化移動イメージ(COまたはCα を対象)
主鎖解析に用いる三次元測定の種類を表1にまとめました。表1の通り、比較的高感度な小さいタンパク質(<10kDa)はCαとCβを同時に検出する条件で測定可能ですが、低感度な大きいタンパク質(>10kDa)ではCαとCβを個別に検出します。
| 炭素種 | 測定法(残基間/残基間+残基内) | |
| 低分子量(<10kDa) | 高分子量(>10kDa) | |
| CO | HNCO / HN(CA)CO | HNCO / HN(CA)CO |
| Cα | CBCA(CO)NH / CBCANH | HN(CO)CA / HNCA |
| Cβ | HN(COCA)CB / HN(CA)CB | |
ここではCOを対象とした場合の主鎖(アミノ酸連鎖)解析の模式図を図5に示します(Cα とCβ も基本的に同一手順です)。
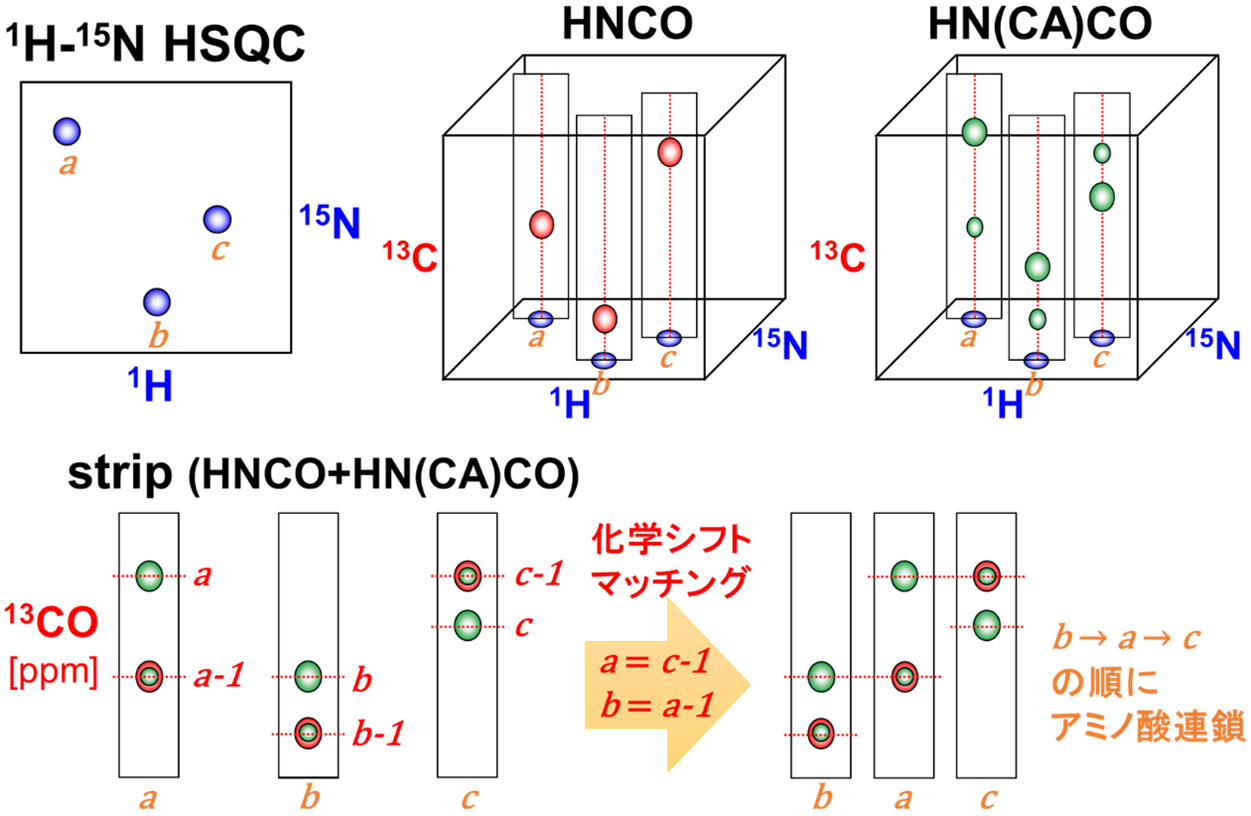
【図5】アミノ酸の連鎖帰属の模式図
解析手順の具体例を以下に記述しました。
1) 1H-15N HSQCピークに通し番号を付け、各三次元測定のstripでピークピックする(図5上段)。
2) ペアとなる三次元測定のstripを重ねて表示し残基内と残基間のピークを区別する。
3) strip間の化学シフト比較(残基内⇔残基間のマッチング)を行い、隣接残基を見つける(図5下段)
(実際にはCα, Cβ, COの3点一致を確認することで曖昧さを無くす)。
4) 3)を繰り返してアミノ酸連鎖を可能な限り伸ばす(両末端とプロリン(アミドNH無し)で途切れる)。
5) CαとCβの化学シフトよりアミノ酸種を推定する(特にグリシンやアラニンは容易に判別可能)。
6) 作成したアミノ酸連鎖がタンパク質配列のどの部分に相当するか帰属し、主鎖解析完了。
④ 試料の主鎖解析結果
実際に測定した試料のHNCOおよびHN(CA)COスペクトルを図6、アミノ酸連鎖帰属を行ったstripの一部抜粋(C末端部の50番目のトレオニン~57番目のグルタミン酸)を図7に示します。1.7mm Cryoプローブを用いると、GB1(6.3kDa)の場合約250μ gの試料量で比較的短時間に解析可能なスペクトルが得られました。
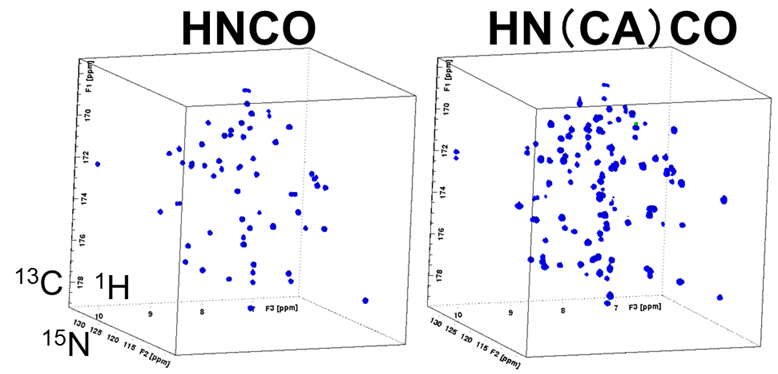
【図6】試料のHNCOおよびHN(CA)COスペクトル
(測定時間:HNCO 3h、HN(CA)CO 6h、非線形サンプリング:12.5%)
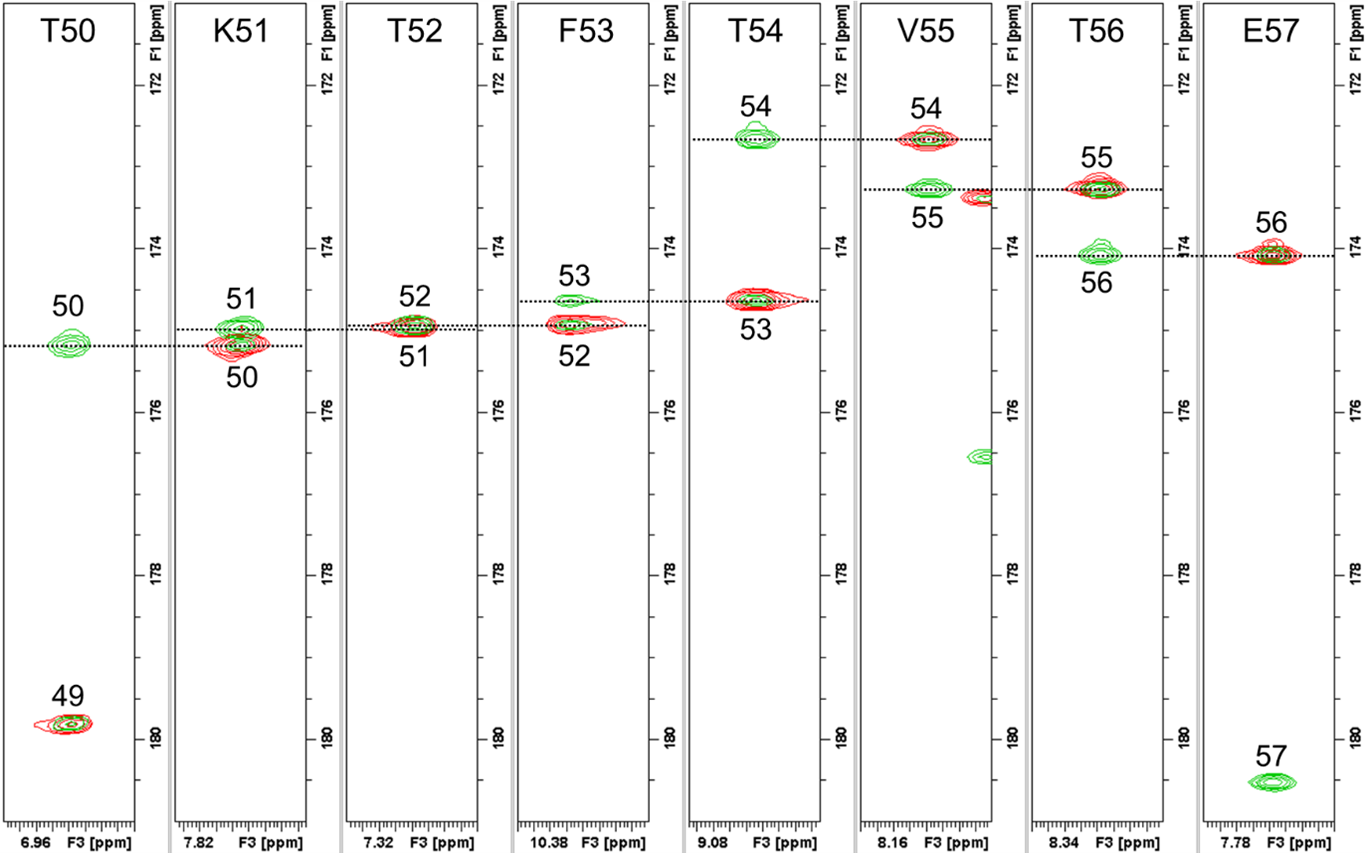
【図7】アミノ酸連鎖帰属を行ったstripの一部抜粋
(HNCO(赤)とHN(CA)CO(緑)の重ね書き、50~57残基)
最終的な試料の主鎖解析結果(1H-15N HSQCスペクトル上に各アミノ酸の帰属を示す)を図8に示します。図8のように主鎖解析まで完了すると、NMRはタンパク質をアミノ酸単位で解析できる強力な分析手段になります。例えば各種条件(温度、pH、リガンド濃度等)を変化させながら1H-15N HSQCスペクトル変化を追跡すると、タンパク質のどの残基が影響を受けたのか把握できます。
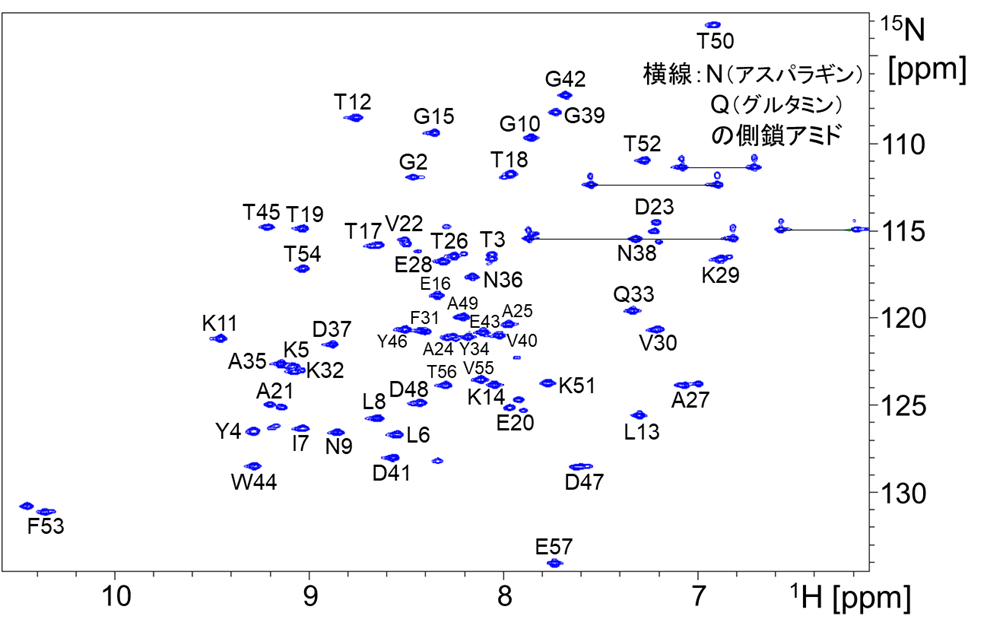
【図8】GB1の主鎖解析結果(1H-15N HSQCスペクトルは図2と同一)
まとめ
溶液NMRによるタンパク質の主鎖解析では、1H-15N HSQCスペクトルのピークを各アミノ酸残基に帰属します。本解析によりNMRは溶液中のタンパク質をアミノ酸単位で観測する手段として使用可能になります(相互作用解析等)。本結果は引き続いて行うタンパク質の側鎖解析および立体構造解析でも利用されます。
