概要
病気の元となるタンパク質の薬剤認識様式(エピトープ)を詳細に解析することで、薬剤認識メカニズムを把握でき、高い結合活性を有する薬剤を開発するための指針を得ることができます。NMRは結晶化等の操作が必要無く、溶液状態で簡便にエピトープ解析が可能です。
本技術資料では、独自に開発したタンパク質―リガンド相互作用解析手法2次元1H-13C DIRECTION-HSQC測定による、糖鎖―タンパク質相互作用系のエピトープ構造解析事例をご紹介します。
分析方法・分析装置
| ・分析方法 | :1次元1H DIRECTION*1、2次元1H-13C DIRECTION-HSQC*2 |
| ・分析装置 | :700MHz NMR、500MHz NMR *1 Difference of inversion recovery rate with and without target irradiation *2 Heteronuclear single quantum coherence |
以下にパルスシーケンスダイアグラムを示します。
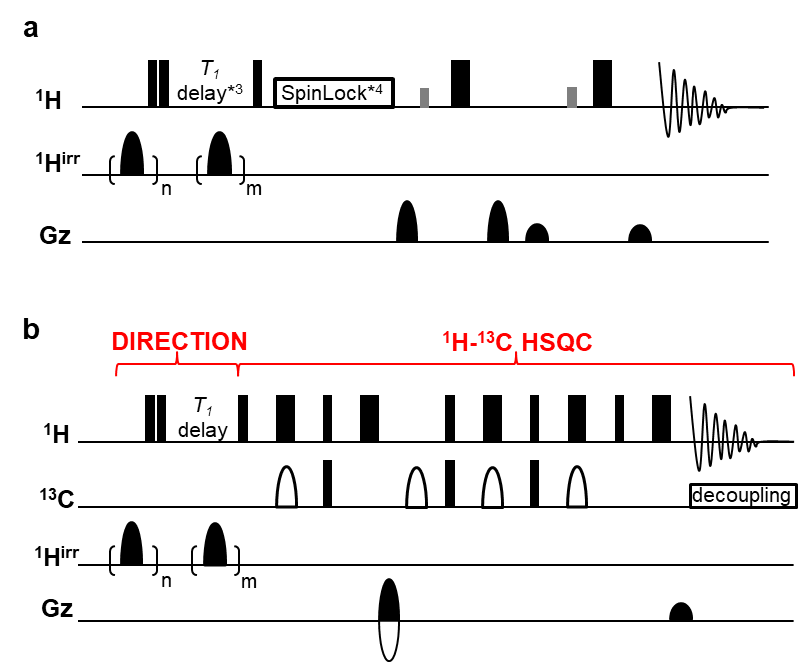
*3 縦緩和遅延時間:DIRECTION法では相互作用の有無を縦緩和時間で検出します
*4 横磁化ロック用パルス:タンパク質の1Hシグナルを減衰させ、綺麗なスペクトルを得ます
試料
ラクトース/レクチン(SNA*5)混合溶液 *5 Sambucus Nigra Agglutinin
濃度:ラクトース 21.7mM、SNA 772µM
溶媒:リン酸緩衝生理食塩水(PBS(-), 100% D2O)
結果
DIRECTION法では、タンパク質にオンまたはオフレゾナンスで飽和パルスを照射した際の、リガンドの縦緩和速度差を解析します(図2a)。1次元DIRECTION測定1)では、単離している1Hピークを解析でき(図2b,c)、エピトーププロファイル(縦軸の値が大きい程、相互作用部位に近い)を得ることが可能です(図2d)。ただし、ピーク重複領域の解析は困難でした(図2b青)。
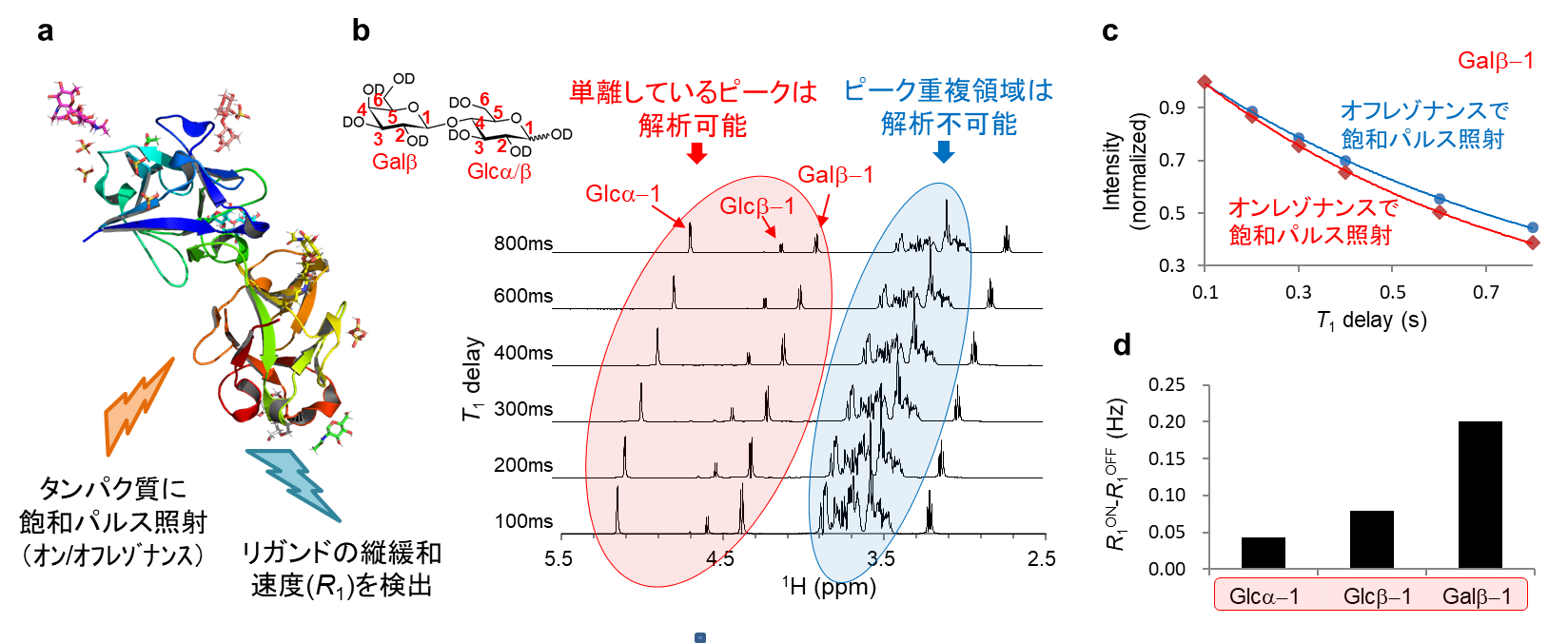
a) DIRECTION法の原理
b) 1次元DIRECTIONスペクトル
c) タンパク質シグナルに対しオン/オフレゾナンスで飽和パルス照射した際のT1緩和曲線
d) 1次元DIRECTIONスペクトル解析結果(エピトーププロファイル)
R1ON:オンレゾナンスでタンパク質に飽和パルスを照射した際の縦緩和速度
R1OFF:オフレゾナンスでタンパク質に飽和パルスを照射した際の縦緩和速度
そこで、弊社では2次元1H-13C DIRECTION-HSQC測定手法を開発しました。これにより、ピーク重複領域の1Hピークも一意的に解析でき、リガンド(ラクトース)の全1H原子のエピトーププロファイルを得ることが可能となりました(図3)。
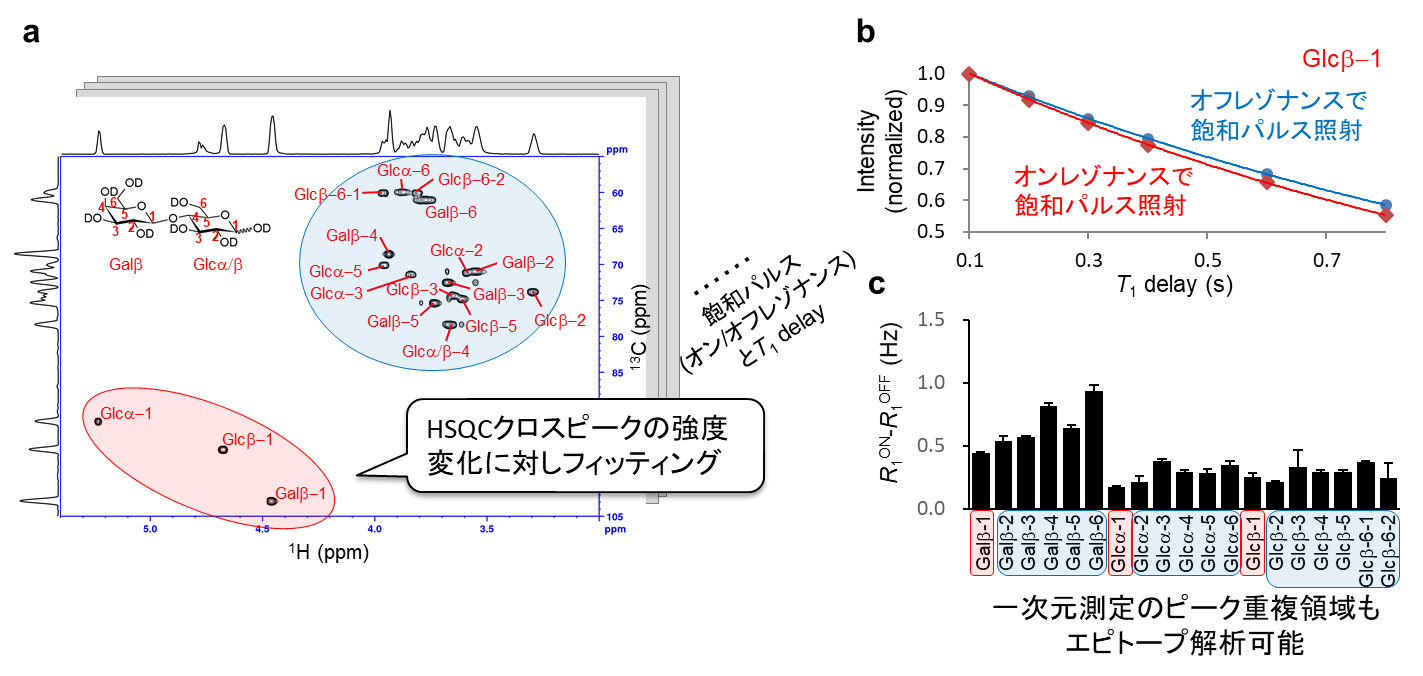
a) 2次元DIRECTION-HSQC測定のイメージ図
b) タンパク質シグナルに対しオン/オフレゾナンスで飽和パルス照射した際のT1緩和曲線
c) 2次元DIRECTION-HSQCスペクトル解析結果(エピトーププロファイル)
ラクトース/SNA相互作用系のDIRECTION-HSQC解析結果を図4aに示します。ラクトース/SNA複合体のX線結晶構造(図4c,d)に基づく1H原子密度予測(図4b)と比較し、相互作用部位であるガラクトース(Gal)のエピトーププロファイルを大凡正しく捉えていると推定されました。
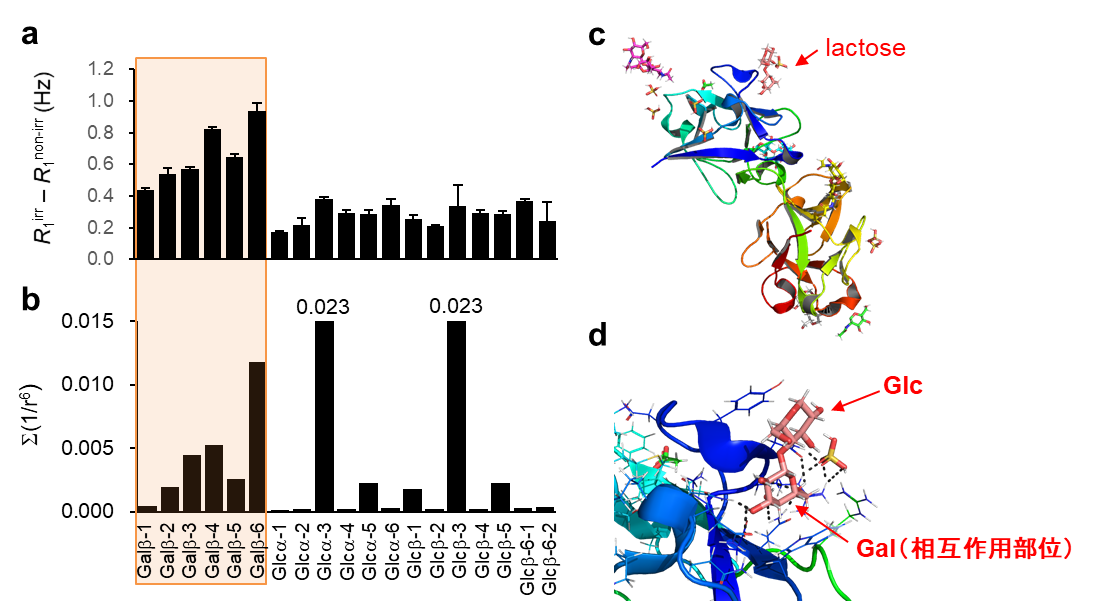
a) 2次元DIRECTION-HSQCスペクトル解析結果(エピトーププロファイル)
b) 結晶構造に基づく1H原子密度予測(≦7Å)
c) ラクトース/SNA複合体のX線結晶構造(PDB-ID:3CA4)
d) ラクトース結合部位のリボンモデル図
まとめ
1次元DIRECTION測定や2次元DIRECTION-HSQC測定を用いることで、エピトープ構造を把握することが可能です。特に2次元DIRECTION-HSQC測定は、1次元測定ではピークが重複する1Hピークについても一意的にエピトープ解析が可能です。またDIRECTION法では、汎用的な測定法である飽和移動差解析(STD)法よりも正確にエピトーブ解析が可能との報告がなされており1)、タンパク質の薬剤認識メカニズムの解析、リード化合物の構造最適化等への応用が期待されます。
参照文献
1) Mizukoshi, Y. et al. Angew. Chem. Int. Ed. Engl. 51, 1362-1365 (2012).
